PENDAHULUAN
Senyawa organik terlibat dalam tiap segi
kehidupan, dan banyak manfaatnya dalam kehidupan manusia sehari-hari. Ada
diantaranya yang berwujud bahan makanan, bahan sandang, obat-obatan, kosmetik,
dan berbagai jenis plastik. Bahkan dalam tubuhpun banyak terdapat sejumlah
senyawa organik dengan fungsi yang beragam pula.Senyawa organik hanya mewakili
satu jenis senyawa kimia, yaitu yang mengandung satu atom karbon atau
lebih. Kimia organik barang kali lebih baik didefinisikan sebagai kimia senyawa
yang mengandung karbon. Meskipun penggolongan seperti ini agak terbatas, fakta
menunjukkan bahwa senyawa yang mengandung atom karbonlah yang banyak terdapat
di muka bumi ini. Fakta ini adalah akibat dari kemampuan atom karbon membentuk
ikatan dengan atom karbon lain. Jika sifat khas ini dibarengi dengan kemampuan
atom karbon membentuk empat ikatan dalam ruang tiga dimensi, maka berbagai
susunan atom dapat terjadi. Saat ini jutaan senyawa organik telah ditentukan
cirinya.
Bentuk umum reaksi ini adalah
Nu: + R-X → R-Nu + X:
Dengan Nu menandakan nukleofil, : menandakan
pasangan elektron, serta R-X menandakan substrat dengan gugus pergi X. Pada
reaksi tersebut, pasangan elektron dari nukleofil menyerang substrat membentuk
ikatan baru, sementara gugus pergi melepaskan diri bersama dengan sepasang
elektron. Produk utamanya adalah R-Nu. Nukleofil dapat memiliki muatan listrik
negatif ataupun netral, sedangkan substrat biasanya netral atau bermuatan
positif. Contoh substitusi nukleofilik adalah hidrolisis alkil bromida,
R-Br, pada kondisi basa, di mana nukleofilnya adalah OH− dan gugus perginya
adalah Br-.
R-Br + OH− → R-OH + Br−
Reaksi substitusi nukleofilik sangat umum
dijumpai pada kimia organik, dan reaksi-reaksi ini dapat dikelompokkan sebagai
reaksi yang terjadi pada karbon alifatik, atau pada karbon aromatik atau
karbon tak jenuh lainnya.
ALKIL HALIDA

Alkil
Halida: adalah senyawa-senyawa yang mengandung halogen yang terikat pada atom
karbon jenuh (atom karbon
yang terhibridisasi sp3).
Contohnya :
5-Bromo-2,4-dimetilheptana 2-Bromo-4,5-dimetilheptana
KLASIFIKASI ALKIL HALIDA
Berdasarkan
jumlah atom karbon yang terikat pada atom karbon yang mengandung halogen.
1. Metil
halida (CH3X):
2. Alkil
halida primer (1o): Sebuah karbon yang terikat pada karbon C-X.
CH3CH2 –
CH2X
3. Alkil
halida sekunder (2o): Dua karbon terikat pada karbon C-X.
CH3CH2 –
CHX
|
CH3
4. Alkil
halida tersier (3o): Tiga karbon terikat pada karbon
C-X.
CH3
|
H3C
– C – X
|
CH3
STRUKTUR ALKIL HALIDA
Ikatan C-X
(karbon-halogen) : overlap antara orbital hibrid sp3C dengan orbital
halogen à C mempunyai geometri tetrahedral dengan sudut ikatan ±109o.
↓
Halogen
lebih elektronegatif dibanding karbon:
à Ikatan C – X akan terpolarisasi:
elektron ikatan ditarik lebih ke arah halogen (x) dibanding ke arah karbon (c)
à Karbon
bermuatan positif parsial (d+) dan halogen negatif parsial (d-)
d+ d-
C X
Karena atom
karbon terpolarisasi positif, maka alkil halida adalah suatu elektrofil.
ELEKTROFIL (suka
elektron) :
yaitu suatu reagen yang miskin elektron (electron-poor)
dan dapat membentuk ikatan dengan menerima sepasang elektron dari suatu reagen
yang kaya elektron(elektron-rich-reagent).
REAKSI SUBSTITUSI NUKLEOFILIK dan REAKSI ELIMINASI
a. Reaksi
Substitusi, yaitu reaksi yang atom, ion atau gugus dari suatu substrat digantikan oleh atom, ion, atau gugus lain
1). Substitusi Nukleofilik (SN) :
Penggantian atom atau gugus atom dari suatu molekul atau nukleofil.
Nukleofil: spesies yang mempunyai
atom dengan orbital terisi 2 elektron (pasangan elektron)
2). Substitusi Elektrofilik (SE)
Pada umumnya terjadi pada senyawa
aromatik, sedangkan pada alifatik sangat jarang secara umum persamaan reaksi
sbb:
R–Y + E+ R–E + Y+
Substrat Pereaksi Produk Leaving
grup
Penyerang
1. Reaksi
Substitusi Nukleofilik (SN)
Suatu
nukleofil (Z:) menyerang alkil halida pada atom karbon hibrida-sp3 yang
mengikat halogen (X), menyebabkan terusirnya halogen oleh nukleofil. Halogen
yang terusir disebut gugus pergi. Nukleofil harus mengandung pasangan elektron
bebas yang digunakan untuk membentuk ikatan baru dengan karbon. Hal ini
memungkinkan gugus pergi terlepas dengan membawa pasangan elektron yang tadinya
sebagai elektron ikatan. Ada dua persamaan umum yang dapat dituliskan:

Contoh masing-masing reaksi adalah:
2. Mekanisme Reaksi Substitusi Nukleofilik
Pada
dasarnya terdapat dua mekanisme reaksi substitusi nukleofilik. Mereka
dilambangkan dengan SN2 adan SN1. Bagian SN menunjukkan substitusi nukleofilik,
sedangkan arti 1 dan 2 akan dijelaskan kemudian.
Nukleofil menyerang dari belakang
ikatan C-X. Pada keadaan transisi, nukleofil dan gugus pergi berasosiasi dengan
karbon di mana substitusi akan terjadi. Pada saat gugus pergi terlepas dengan
membawa pasangan elektron, nukleofil memberikan pasangan elektronnya untuk
dijadikan pasangan elektron dengan karbon. Notasi 2 menyatakan bahwa reaksi
adalah bimolekuler, yaitu nukleofil dan substrat terlibat dalam langkah penentu
kecepatan reaksi dalam mekanisme reaksi. Adapun ciri reaksi SN2
adalah:
1. Karena nukleofil dan substrat terlibat dalam
langkah penentu kecepatan reaksi, maka kecepatan
reaksi tergantung pada konsentrasi kedua spesies tersebut.
2. Reaksi terjadi dengan pembalikan (inversi)
konfigurasi. Misalnya jika kita mereaksikan (R)-2-bromobutana dengan natrium
hidroksida, akan diperoleh (S)-2-butanol.Ion hidroksida menyerang dari belakang
ikatan C-Br. Pada saat substitusi terjadi, ketiga gugus yang terikat pada
karbon sp3 kiral itu seolah-olah terdorong oleh suatu bidang datar sehingga
membalik. Karena dalam molekul ini OH mempunyai perioritas yang sama dengan Br,
tentu hasilnya adalah (S)-2-butanol. Jadi reaksi SN2 memberikan hasil
inversi.
3. Jika substrat R-L bereaksi melalui mekanisme SN2,
reaksi terjadi lebih cepat apabila R merupakan gugus metil atau primer, dan
lambat jika R adalah gugus tersier. Gugus R sekunder mempunyai kecepatan
pertengahan. Alasan untuk urutan ini adalah adanya efek rintangan sterik.
Rintangan sterik gugus R meningkat dari metil < primer < sekunder <
tersier. Jadi kecenderungan reaksi SN2 terjadi pada alkil halida adalah: metil
> primer > sekunder >> tersier.
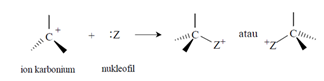
B. Reaksi SN1 Mekanisme SN1 dalah proses dua
tahap. Pada tahap pertama, ikatan antarakarbon dengan gugus pergi putus.
Gugus
pergi terlepas dengan membawa pasangan elektron, dan terbentuklah ion
karbonium. Pada tahap kedua (tahap cepat), ion karbonium bergabung dengan
nukleofil membentuk produk
Pada mekanisme SN1, substitusi terjadi dalam dua tahap. Notasi 1 digunakan
sebab pada tahap lambat hanya satu dari dua pereaksi yang terlibat, yaitu
substrat. Tahap ini sama sekali tidak melibatkan nukleofil.
Berikut ini adalah ciri-ciri suatu
reaksi yang berjalan melalui mekanisme SN1:
1. Kecapatan reaksinya tidak tergantung pada
konsentrasi nukleofil. Tahap penentu kecepatan reaksi adalah tahap pertama di
mana nukleofil tidak terlibat.
2. Jika karbon pembawa gugus pergi adalah bersifat
kiral, reaksi menyebabkan hilangnya aktivitas optik karena terjadi rasemik.
Pada ion karbonium, hanya ada a gugus yang terikat pada karbon positif. Karena
itu, karbon positif mempunyai hibridisasi sp2 dan berbentuk planar. Jadi
nukleofil mempunyai dua arah penyerangan, yaitu dari depan dan dari belakang.
Dan kesempatan ini masing-masing mempunyai peluang 50 %. Jadi hasilnya adalah
rasemit. Misalnya, reaksi (S)-3-bromo-3-metilheksana dengan air menghasilkan
alkohol rasemik.

Spesies antaranya (intermediate species) adalah ion karbonium dengan
geometrik planar sehingga air mempunyai peluang menyerang dari dua sisi (depan
dan belakang) dengan peluang yang sama menghasilkan X yang melalui mekanisme
SN1-adalah campuran rasemik Reaksi substrat R akan berlangsung cepat jika R merupakan
struktur tersier, dan lambat jika R adalah struktur primer. Hal ini sesuai
dengan urutan kestabilan ion karbonium, 3o > 2o >> 1o.
C. Perbandingan Mekanisme SN1 dan
SN2
Tabel berikut memuat ringkasan
mengenai mekanisme substitusi dan mebandingkannya dengan keadaan-keadaan lain,
seperti keadan pelarut dan struktur nukleofil.Tabel1: Perbandingan reaksi SN2
dengan SN1
Pada tahap pertama dalam mekanisme SN1 adalah tahap pembentukan ion, sehingga
mekanisme ini dapat berlangsung lebih baik dalam pelarut polar. Jadi halida
sekunder yang dapat bereaksi melalui kedua mekanisme tersebut, kita dapat
mengubah mekanismenya dengan menyesuaikan kepolaran pelarutnya. Misalnya,
mekanisme reaksi halida sekunder dengan air (membentuk alkohol) dapat diubah dari
SN2 menjadi SN1 dengan mengubah pelarutnya dari 95% aseton-5% air (relatif
tidak-polar) menjadi 50% aseton-50% air (lebih polar, dan pelarut peng-ion
yanglebih baik). Kekuatan nukleofil juga dapat mengubah mekanisme reaksi yang
dilalui oleh reaksi oleh reaksi SN. Jika nukleofilnya kuat maka mekanisme SN2
yang terjadi.
3. Reaksi eliminasi, yaitu
pelepasan atom atau gugus atom.
Merupakan
reaksi samping pada reaksi substitusi, dikenal dengan eliminsi E1 dan E2.
a. Mekanisme reaksi E1
Mekanisme reaksi E1 merupakan alternatif dari mekanisme reaksi SN1.
Karbokation dapat memberikan sebuah proton kepada suatu basa dalam reaksi
eliminasi. Mekanisme reaksi E1 terdiri dari dua tahap. Perhatikan contoh
berikut :
Tahap 1.
Tahap 1 reaksi E1 berjalan lambat.
Tahap 2.
Tahap 2 reaksi E1 berjalan cepat.

Mekanisme reaksi E2
Reaksi E2 menggunakan basa kuat
seperti OHˉ, ORˉ, dan juga membutuhkan kalor. Dengan memanaskan alkil halida
dalam KOH, CH3CH2ONa.
Permasalahannya :
1. Dari uraian diatas jika kekuatan nukleofil
juga dapat mengubah mekanisme reaksi yang dilalui oleh reaksi SN. Jika
nukleofilnya kuat maka mekanisme SN2 yang terjadi. Bagaimana mengetahui apakah
suatu nukleofil adalah kuat atau lemah?
2. Reaksi
substitusi atau disebut reaksi pertukaran gugus fungsi terjadi saat atom atau
gugus atom dari suatu senyawa karbon digantikan oleh atom atau gugus atom lain
dari senyawa yang lain. Jika pada reaksi substitusi nukleofilik atom/
gugus yang diganti mempunyai keelektronegativan lebih kecil dari atom C,apakah
reaksi tidak akan berlangsung?mengapa terjadi hal demikian?
3.
Bagaimana reaksi substitusi
nukleofilik senyawa Aromatik dan senyawa Alifatik?








Saya akan menjawab permasalahan pertama,
BalasHapusKekuatan nukleofilik dari atom dapat dijelaskan dengan melihat produk yang akan terbentuk, jika atom-aton bertindak sebagai nukleofil. Petunjuk lain untuk mengetahui apakah suatu nukleofik kuat ataukah lemah ialah, pada periode yang sama, unsur yang lebih elektronegatif cendrung merupakan nukleofil yang lebih lemah karena lebih kuat memegang elektron, dan unsur yang berbeda pada periode dalam tabel periodik cendrung merupakan nukleofil yang lebih kuat dari pada unsur yang berada dalam periode di atasnya yang segolongan.
saya akan menjawab pertanyaan permasalahan kedua
BalasHapusgugus pengganti atau nukleofil kaya akan elektron sehingga elektronegativasnya tinggi. elektronegativas yang tinggi tersebut di gunakan nukleofil untuk menyerang substrat (atom C) untuk membentuk ikatan baru. Jadi,menurut saya apabila nukleofil elektronegativasnya rendah tidak dapat menyerang/bereaksi dengan atom C membentuk ikatan baru.
Saya heni yulianti(A1C116034) akan mencoba menjawab permasalahan ketiga
BalasHapusReaksi substitusi nukleoflik senyawa aliatik biasanya terjadi pada senyawaalkil halida #-2'. Atom karbon yang mengikat halida pada alkil halida ini,mempunyai muatan parsial positi, sehingga mudah diserang oleh nukleofl. 0ikagugus perginya adalah ion halida, maka gugus ini merupakan gugus pergi yangbaik karena ion-ion halidanya merupakan basa yang sangat lemah dan mudahdigantikan oleh nukleoflik
Dan pengaruh substitusi nukleofilik terhadap senyawa aromatik adalah untuk membentuk senyawa baru yang lebih baik. Selain itu juga menyebabkan terjadinya gugus pergi berupa halida yang disebabkan oleh resonansi yang terjadi akibat masuknya nukleofil dari belakang pada gugus karbonil.